L'anodisation de l'aluminium
Comme d'autres constructeurs amateurs de télescopes, nous réalisons la plupart des pièces mécaniques de nos instruments en aluminium ou, plus exactement, en alliage d'aluminium. En effet, comme la plupart des autres métaux l'aluminium a des propriétés mécaniques décevantes lorsqu'il est employé pur. Pour améliorer ses caractéristiques on lui incorpore un ou plusieurs éléments en formant ainsi un alliage.
Les alliages d'aluminium sont légers et faciles à usiner mais leur surface est fragile. Celle-ci est sensible à la corrosion, elle très vulnérable aux salissures, ne serait-ce que par le simple contact des doigts, et son exposition à l'air ternit son aspect.
Il existe un grand nombre de techniques de protection pour ces alliages dont voici une liste non exhaustive :
- Métallisation au pistolet (on recouvre la surface par projection d'un métal protecteur)
- Métallisation chimique (on recouvre la surface avec un métal déposé chimiquement)
- Métallisation sous vide
- Flocage (on recouvre la surface avec une couche de matière plastique ou de textile)
- Peinture
- Email
- Oxydation anodique ou anodisation
- etc.
Pour la finition des pièces mécaniques de nos télescopes, nous avons choisi de les anodiser (comme bien d'autres avant nous). C'est un mode d'emploi de cette technique que nous allons exposer ici.
L'aluminium
Après l'oxygène et le silicium, l'aluminium est l'élément le plus abondant dans la croute terrestre (8% environ). Toutefois, les préoccupations de rentabilité limitent son extraction essentiellement au minerai de bauxite.
Il est produit de façon industrielle seulement depuis la fin du 19ieme siècle et pourtant c'est aujourd'hui le métal le plus employé après le fer. L'aluminium est un métal dont la densité est faible, c'est pour cela que ses alliages sont aussi dénommés "alliages légers". L'aluminium est le métal le plus léger après le lithium, le béryllium et le magnésium.
| Lithium | |
| Magnésium | |
| Béryllium | |
| Aluminium | |
| Titane | |
| Fer | |
| Cuivre | |
| Plomb |
L'aluminium conduit bien l'électricité et la chaleur, il n'est pas magnétique.
Ce métal s'oxyde spontanément au contact de l'air. La couche d'oxyde qui le recouvre est appelée alumine. Il s'agit d'un corps très dur et transparent qui isole le métal et qui ne se propage pas vers l'intérieur comme peut le faire la rouille sur le fer.
La désignation des alliages d'aluminium
La résistance mécanique de l'aluminium est relativement faible mais elle peut être fortement augmentée par l'addition d'autres métaux.
L'élément ajouté influence certaines caractéristiques qui peuvent être :
- Résistance à la rupture
- Limite élastique
- Allongement à la rupture
- Masse volumique
- Conductivité électrique et / ou thermique
- Résistance à la corrosion
- Résistance à la température
- Aptitude au soudage
- Facilité d'usinage
- Aptitude aux traitements de surface
- etc.
Désignation alphanumérique : L’Association française de normalisation (AFNOR) qui est l'organisme officiel français de normalisation a défini une désignation alphanumérique qui est encore utilisée pour les alliages d'aluminium.
Pour référencer les métaux elle emploie des symboles abrégés qui sont parfois semblables à la désignation classique et parfois très différents comme le montre selon le tableau suivant :
Exemple : A-U4G est un alliage d'aluminium à 4 % de cuivre et contenant du magnésium. Il était anciennement appelé Duralumin.
Désignation numérique de la norme européenne EN 485-2 : Cette désignation est originaire des Etats-Unis, elle commence par la lettre A (pour aluminium) suivie par un nombre de 4 chiffres (souvent on cite seulement ce nombre en oubliant la lettre A). Cette expression peut être précédée par les lettres EN pour spécifier la norme employée.
Le premier chiffre indique l'élément d'alliage. A l'exception de la série 1000, les autres chiffres n'ont pas de signification particulière, ils servent seulement à numéroter l'alliage.
Série 1000 : aluminium non allié
Série 2000 : aluminium + cuivre
Série 3000 : aluminium + manganèse
Série 4000 : aluminium + silicium
Série 5000 : aluminium + magnésium
Série 6000 : aluminium + magnésium + silicium
Série 7000 : aluminium + Zinc
Série 8000 : aluminium + autres métaux Pour comprendre la technique de l'anodisation de l'aluminium, il faut d'abord étudier l'électrolyse de l'eau. Il s'agit d'un phénomène provoqué par le passage d'un courant électrique dans l'eau.
La figue 1 montre une expérience d'électrolyse de l'eau. Deux électrodes sont plongées dans un récipient d'eau. Elles sont constituées d'un matériel inerte, c'est à dire qui n'intervient pas dans la réaction.
On génère un courant électrique qui traverse le volume d'eau.
L'établissement du courant électrique provoque l'apparition de bulles de gaz qui s'élèvent au-dessus des électrodes. On mesure en volume deux fois plus de gaz produit sur l'électrode reliée à la borne négative de l'alimentation.
En fait, l'eau est décomposée par le courant électrique. La réaction de l'électrolyse suit l'équation suivante :
Cette expression indique que les molécules d'eau H2O sont décomposées en hydrogène H2 et en oxygène O2. Précisément, deux molécules d'eau en se décomposant libèrent deux molécules d'hydrogène et une molécule d'oxygène. Ceci explique que le volume d'hydrogène obtenu est double de celui de l'oxygène.
Dans les conditions normales, les atomes de ces deux éléments se regroupent en molécules de deux atomes. Il est donc plus juste de dire que l'eau est décomposée en dihydrogène et en dioxygène.
Conventionnellement on admet que le courant électrique se déplace dans un circuit depuis la borne positive vers la borne négative de l'alimentation électrique mais ce n'est pas le cas des électrons. Ces particules chargées négativement se déplacent en sens inverse, c'est à dire depuis la borne négative vers la borne positive.
Dans un circuit électrique, les électrons se déplacent dans le sens opposé au sens conventionnel de propagation du courant électrique.
La borne négative est la cathode, elle émet des électrons qui sont recueillis par les atomes d'hydrogène des molécules d'eau. Ceux-ci devenus électriquement neutres sont libérés de leur association avec l'oxygène et ils vont se regrouper par deux pour former des molécules de dihydrogène (gazeux dans les conditions normales).
Les atomes d'oxygène ont conservé les électrons que les atomes d'hydrogène avaient apportés à leur association et ils deviennent des ions négatifs. Ils sont alors attirés par l'électrode positive ou anode qui leur arrache ces électrons excédentaires. Ils deviennent eux-aussi électriquement neutres et ils vont à leur tour se regrouper par deux pour former des molécules de dioxygène (gazeux dans les conditions normales).
Il s'agit d'une électrolyse de l'eau comme nous venons de la considérer mais l'objet à traiter (en alliage d'aluminium) constitue l'anode. Dans ce cas l'oxygène s'associe directement au métal en formant une couche d'oxyde d'aluminium que l'on appelle alumine.
Au début du 20ieme siècle, ce processus était nommé d'une façon plus expressive "oxydation anodique".
La couche d'alumine ainsi formée est très dure, isolante et peut être colorée. Elle protège donc l'aluminium tout en répondant aux préoccupations décoratives.
Précédemment nous avons défini l'électrolyse de l'eau d'une façon "théorique". En pratique, on ne peut pas employer de l'eau pure car elle ne conduit pas l'électricité et il faut utiliser une solution ionique. C'est à dire qu'on dissout dans cette eau un corps qui se décompose en ions (ce sont des atomes ou des groupes d'atomes électriquement chargés). Ce bain conducteur d'électricité dans lequel on traite la pièce est appelé électrolyte.
L'électrolyte que nous allons employer est constitué par une solution d'acide sulfurique. C'est cet acide qui est utilisé le plus souvent pour anodiser l'aluminium bien que d'autres électrolytes puissent être envisagés. La présence de l'acide sulfurique dans l'eau ne modifie pas la réaction de décomposition de l'eau telle que nous l'avons exposée plus haut. L'acide assure la conductivité électrique et il permet ainsi à la réaction d'être efficace.
En se mélangeant à l'eau, l'acide sulfurique H2SO4 se dissocie en ions :
La figure 2 illustre schématiquement une installation d'anodisation.
Il faut noter que tous les alliages d'aluminium ne réagissent pas à l'anodisation aussi bien les uns que les autres, il convient donc de choisir l'alliage avant de réaliser une pièce pour éviter une déception.
L'anodisation donne d'excellents résultats sur les alliages faiblement alliés des séries 5000 et 6000. C'est pour cela que nous utilisons le 5056 ou le 5774 quand nous nous intéressons à l'esthétique de la pièce et notamment si nous voulons la colorer.
Quand nous ne pouvons pas nous procurer ces métaux, nous choisissons le commun 2017 (= A-U4G). Le résultat est acceptable bien qu'un peu moins flatteur.
D'autres alliages peuvent donner des résultats tout à fait décevants.
Remarque : Aucun autre métal ne doit participer à la réaction d'anodisation. Il n'est donc pas possible de traiter ainsi une pièce en alliage d'aluminium qui serait fixée ou sertie à un objet en acier (par exemple).
Alumine est le nom de l'oxyde d'aluminium, c'est le composé chimique formé par l'oxydation de l'aluminium et sa formule chimique est Al2O3. L'alumine est un minéral très dur, à tel point qu'on l'emploie dans les meules sous sa forme cristallisée qui constitue le corindon.
On trouve dans la nature certaines variétés rares et précieuses de cet oxyde dont les impuretés le colorent en rouge, c'est le rubis, ou en bleu pour constituer le saphir.
Pour l'anodisation, l'anode est constituée par la pièce en alliage d'aluminium que l'on veut traiter. Sa surface est exposée directement à l'oxygène formé par la décomposition de l'eau et elle est le lieu de la réaction suivante :
Pendant l'anodisation, on remarque des bulles qui s'échappent de la surface traitée. Cela démontre que la surface de l'alliage d'aluminium ne capte pas toute la quantité de l'oxygène produit et qu'une partie s'échappe sous forme gazeuse. Pour être complet, il faut aussi signaler qu'une partie du métal est dissoute dans l'électrolyte.
Structure poreuse de l'alumine :
Le traitement électrolytique produit une couche d'alumine beaucoup plus épaisse en progressant de l'extérieur vers l'intérieur. Ce dernier point peut paraître paradoxal puisque l'alumine est un isolant. En fait, sa structure est poreuse et permet ainsi à l'électrolyte de conduire le courant électrique jusqu'au métal.
Lors de l'anodisation, l'alumine forme un maillage de cellules hexagonales avec en leur milieu un pore qui se prolonge jusqu'au métal. C'est à la base de ces pores que se forme l'alumine en progressant vers l'intérieur.
Le diamètre des pores dépend notamment de la nature de l'électrolyte mais il ne varie pas en fonction de l'intensité du courant électrique. Par contre, la distance entre les pores est influencée par cette intensité, en augmentant le courant on éloigne les pores. La dimension des cellules est habituellement comprise entre 10 et 50nm.
Epaisseur de l'alumine :
avec : I/S = densité du courant en mA/cm2
Ainsi, avec un courant électrique de 15mA/cm2 l'épaisseur de la couche d'alumine se forme à la vitesse de 0,435 µm/mn. En une demi-heure (soit 30 minutes), il se forme une couche d'alumine de 0,435 x 30 = 13µm.
L'épaisseur de cette couche protectrice influence légèrement les dimensions de la pièce traitée car elle vaut approximativement le double de l'épaisseur de l'aluminium enlevé par le traitement. Après l'anodisation, une moitié de cette épaisseur se trouve au-dessus de la surface initiale. Notez toutefois qu'il s'agit d'une approximation et il est préférable de faire un essai préalable pour éviter toute surprise sur une pièce de haute précision. En effet, suivant le traitement et le métal choisis, la valeur de cette surépaisseur peut augmenter jusqu'à 70% de l'épaisseur totale de l'alumine.
Pour la plupart des pièces que nous réalisons en alliage d'aluminium, nous les anodisons pendant une demi-heure avec un courant de 10mA/cm2.
Concentration de l'acide :
L'acide sulfurique destiné aux batteries de voiture convient très bien pour l'anodisation de l'aluminium. Le même bain peut être employé pendant des mois, voire des années dans un atelier professionnel. Lorsqu'elle devient importante, c'est la quantité d'aluminium dissous qui rend nécessaire le changement de bain.
Une quantité trop importante d'aluminium dans l'acide est nuisible mais son absence totale n'est pas bonne pour autant. Les meilleurs résultats sont obtenus avec un bain qui a déjà été employé. C'est pour cela que certains, au moment du renouvellement du bain, conservent une partie (20 à 30%) de l'acide usagé.
Température de l'électrolyte :
En pratique, on procède entre 18 et 22°C et il faut veiller à ne pas dépasser 24°C car au-delà de cette valeur, l'alumine se dissous trop vite dans l'acide.
Intensité du courant d'anodisation :
Il n'est donc pas question d'employer une alimentation qui serait simplement redressée comme celle qui constitue un chargeur de batterie pour voiture.
Pendant un temps, nous avons utilisé une alimentation régulée en tension. Un ampèremètre indiquait l'intensité du courant et nous intervenions périodiquement sur la tension fournie afin de réguler la valeur du courant. Ce n'était pas une bonne idée car nos résultats étaient irréguliers surtout pour les pièces colorées.
Nous employons maintenant une alimentation régulée en courant et nos résultats sont très satisfaisants.
Bien entendu, il ne faut pas modifier le réglage du courant en cours d'opération. Il faut régler sa valeur avant de l'appliquer et ne plus le modifier ensuite.
La valeur recommandée pour le courant varie selon les auteurs de 8 à 25 mA par cm2. Nous-mêmes, nous choisissons habituellement un courant de 10 mA/cm2.
Pour faire bref, un courant électrique est un flux d'électrons (qui se mesure en Ampères) qui se déplacent sous l'influence d'une tension (qui se mesure en volts).
1 Ampère correspond à un flux de 6,241.1018 électrons par seconde.
Le plus souvent, on nomme alimentation un dispositif qui génère une tension continue "u" et qui fonctionne correctement tant que le courant "i" ne dépasse pas une valeur limite. La figure A1 montre l'évolution de la tension fournie par une alimentation régulée en tension. La tension est constante jusqu'à un courant limite à partir duquel la tension diminue d'une façon différente suivant le type d'alimentation. Les lignes pointillées montrent des exemples. Un "retour en arrière" de la courbe peut être voulu en prévention des courts-circuits.
L'alimentation représentée par la ligne verte et continue de la figure A1 peut aussi être considérée comme un générateur de courant constant tant que la tension ne dépasse pas une limite.
Pour ce type d'alimentation, on peut renverser la figure en intervertissant u et i. On obtient la figure A2 caractéristique d'une régulation en courant. Pour être plus complet, une "vraie" alimentation régulée en courant permet d'ajuster finement le courant choisi. Ainsi, elle alimente notre dispositif d'électrolyse avec un courant constant. Il faut toutefois qu'elle puisse délivrer une tension d'une quinzaine de volts.
Pour terminer cet aperçu, la figure A3 illustre l'évolution de la tension que l'on obtient en sortie d'une alimentation simplement redressée comme l'est bien souvent un chargeur de batterie pour automobile.
Elle n'est régulée, ni en tension, ni en courant, et elle ne convient pas à l'anodisation.
Le colmatage :
Après l'anodisation, les pores de l'alumine doivent être refermés pour une meilleure résistance de cette couche protectrice et pour éviter qu'elle ne retienne des corps indésirables qui pourraient être corrosifs ou inesthétiques. C'est l'opération du «colmatage» ou «fixage». La méthode la plus utilisée pour cela consiste à faire séjourner le matériau dans l'eau bouillante.
On peut profiter de ce phénomène pour introduire un colorant avant le colmatage. Le colorant ainsi emprisonné garantit une coloration très résistante au frottement.
L'alumine formée pendant l'anodisation ne contient pas d'eau et elle s'hydrate au contact de l'eau bouillante. L'eau qui pénètre ainsi dans l'alumine provoque une augmentation de son volume qui referme les pores.
Lors du colmatage, l'eau se combine avec l'alumine pour former un corps stable qui résiste à une température supérieure à 400°C.
Pour que le colmatage soit efficace, il faut que la pièce séjourne dans l'eau bouillante pendant un temps au moins égal à la durée de son anodisation.
Le colmatage peut être réalisé avec une température inférieure à celle de l'ébullition de l'eau mais alors il faut beaucoup augmenter la durée. En tout cas, au-dessous de 50°C ce n'est plus possible.
Des impuretés dans l'eau même en très faible quantité peuvent contrarier le colmatage, c'est pour cela qu'il faut réaliser cette opération avec de l'eau déminéralisée.
Mise en garde IMPORTANTE :
Pour réaliser une anodisation, nous devons utiliser l'acide sulfurique ainsi que la soude caustique. Ces produits chimiques sont corrosifs et provoquent de graves brûlures, ils doivent être manipulés avec précaution.
Ces produits ne doivent pas être disposés à la portée d'un enfant.
Pour l'utilisation de l'acide sulfurique ou de la soude caustique, il faut porter un vêtement de protection approprié, des gants en plastique compatible avec les produits utilisés et un dispositif de protection des yeux ou du visage.
Notez que le code du travail interdit la manipulation de ces produits par les mineurs. Cette loi vaut aussi bien pour les établissements scolaires que pour les entreprises et même pour les associations...
Conduite à tenir en cas de contact avec la peau : rincer abondamment avec de l'eau.
Conduite à tenir en cas de contact avec l'œil : rincer à l'eau et consulter un ophtalmologiste.
Si vous tenez à un vêtement qui vient de recevoir de l'acide sulfurique ou de la soude caustique, rincez-le immédiatement.
Conditions de travail :
Pour ces raisons, il est impératif d'effectuer l'anodisation dans un lieu bien aéré et éloigné de tout élément métallique (notamment en fer) que l'on souhaite préserver.
Il faut aussi être à proximité immédiate d'un lavabo autant pour des raisons pratiques que pour la sécurité.
Nous espérons que vous comprendrez que la fréquentation du lieu doit être contrôlée. En effet, il ne faut surtout pas laisser la possibilité d'approcher à des enfants ou à des animaux car leur comportement est imprévisible et peut donc être dangereux.
Notre équipement :
La cuve :
Ce récipient comporte un bec verseur, c'est très appréciable quand nous vidons l'acide dans son bidon à travers un entonnoir. Imaginez la difficulté pour remettre proprement l'acide dans son récipient de stockage sans ce bec verseur...
Or ce transvasement est fréquent à cause des préoccupations de température. En effet, si l'acide est trop chaud, nous le remettons dans son bidon pour placer celui-ci un moment dans un réfrigérateur.
L'alimentation électrique :
Bien entendu, nous l'utilisons en générateur de courant constant. Lors de l'anodisation des alliages d'aluminium, la tension de sortie fluctue entre 7 et 12 volts, c'est pour cela que nous réglons la tension limite de sortie à 15 volts.
La valeur du courant est réglée en fonction de la surface de la pièce à traiter. Nous l'obtenons en multipliant la surface en cm2 par la densité de courant que nous choisissons habituellement à 10 mA/cm2. Exemple : pour une pièce qui a une surface de 100cm2, il nous faudra un courant de 100 x 10 = 1000 mA ou si vous préférez 1 Ampère.
La cathode :
Dans l'acide, nous devons aussi disposer une cathode (reliée au pôle négatif). Elle est constituée en plomb et sa dimension n'est pas critique. Nous utilisons pour cet usage une plaque de plomb obtenue à partir d'un morceau de tuyauterie en plomb qui était destiné au rebut.
Pour la réaliser, nous avons fendu le tuyau de plomb sur toute sa longueur puis nous l'avons "déroulé" en ouvrant cette fente. Ensuite, nous l'avons aplati en le matant au marteau sur une surface plane.
Pour terminer, nous avons courbé une extrémité afin qu'elle puisse s'accrocher au bord de la cuve d'acide.
Le plomb peut rester en permanence au contact de l'acide sulfurique sans inconvénient.
Le fil conducteur issu du pôle négatif de l'alimentation est pourvu d'une grosse pince crocodile pour pincer fortement cette pièce de plomb (hors de l'acide) afin d'assurer un bon passage du courant.
Le support de la pièce à anodiser :
Elle sera suspendue dans l'électrolyte avec un dispositif conducteur d'électricité.
Afin d'éviter des phénomènes chimiques indésirables entre deux métaux différents, le courant électrique sera amené par l'intermédiaire d'un support constitué en aluminium lui-aussi. Il sera en contact électrique dans l'acide avec notre pièce à traiter et dans l'air avec le conducteur relié à la borne positive de l'alimentation.
Pour concevoir ce support, il suffit d'être créatif en réutilisant des morceaux de tiges ou de tringles en aluminium.
Cet élément intermédiaire doit être pressé fortement contre la pièce à traiter. On peut utiliser pour cela l'élasticité d'une pièce comme dans le cas de l'exemple illustré sur la figure 6. On peut aussi profiter d'un perçage dans lequel on emmanche à force une tige dont l'extrémité a été taillée en forme de cône. Si la pièce comprend un trou taraudé, il suffit de fileter l'extrémité d'une tige qui sera ensuite vissée dedans. Il doit y avoir bien d'autres possibilités...
Il faut aussi se méfier du gaz produit par l'électrolyse. Imaginons par exemple que nous disposions la pièce de la figure 6 avec son axe horizontal. Dans ce cas, nous pouvons prévoir qu'une poche de gaz va se former dans la rainure en haut de la pièce et en cet endroit l'anodisation sera mal effectuée...
Le contact avec le support fera une marque sur la pièce, il faut donc choisir un emplacement qui ne se verra pas.
L'alumine se forme aussi sur ce support et donc, pour chaque réutilisation du support, il faut limer la partie en contact avec la pièce pour assurer un bon contact électrique.
Préparation de la pièce à anodiser :
Taille des grains abrasifs :
Ainsi les grains les plus grossiers sont qualifiés par un petit nombre et les grains les plus fins par un nombre élevé.
Voici un classement de la taille des grains.
Quand la surface est suffisamment lisse, il faut la nettoyer pour éliminer toute trace de corps gras. On peut employer pour cela du savon ordinaire ou un savon liquide pour la vaisselle.
Protection individuelle :
Préparation de l'électrolyte :
Au début du traitement, la température de l'acide doit être comprise entre 18 et 20°C voire légèrement moins car il faut prévoir qu'elle va augmenter sous l'influence du courant électrique et éventuellement de la température ambiante.
Si nécessaire, il faut faire refroidir l'acide au réfrigérateur.
Lorsque nous traitons une pièce d'une surface de 200 cm2 dans 2 litres d'acide, la température de celui-ci augmente d'environ 4 à 5 °C pendant une durée du traitement de 30 minutes. Il faut anticiper cet échauffement pour que la température de l'acide ne dépasse jamais la limite de 24 °C. On comprend donc que cette quantité ne permet pas de traiter convenablement des pièces plus grandes. Pour cela, il faut employer une plus grande quantité d'acide ou prévoir un dispositif de refroidissement de l'acide pendant l'anodisation.
Quand la température est correcte, nous versons notre électrolyte dans la cuve.
Décapage :
D'une part la soude caustique transforme en savon les éventuels corps gras qui demeureraient encore sur la pièce (réaction de saponification) et d'autre part elle dissout l'alumine. Cela peut être l'alumine qui s'est formée spontanément sur le métal ou bien l'alumine issue d'un précédent traitement.
Pour confectionner ce bain de décapage, on peut dissoudre 20 à 50g de soude caustique anhydre par litre d'eau. Une autre possibilité consiste à diluer de la lessive de soude que l'on trouve dans le rayon droguerie des supermarchés. Cette lessive de soude contient 30% de soude caustique, on doit donc diluer 1 volume de lessive de soude dans 9 volumes d'eau pour notre utilisation. Notez bien que la concentration de soude caustique n'est pas critique ici et les proportions que nous indiquons sont très approximatives.
Notre pièce d'aluminium doit séjourner 1 à 3 minutes dans le bain de décapage ou plus longtemps si vous voulez dissoudre une anodisation antérieure.
Dès que la couche d'alumine est dissoute, la soude commence à attaquer l'aluminium. Cette réaction provoque l'apparition de bulles de dihydrogène gazeux. C'est le signe qu'il faut mettre un terme à notre décapage en retirant la pièce de ce bain et en la rinçant avec l'eau du robinet. Il ne faut plus la toucher avec les doigts car ils déposeraient des corps gras. On manipule donc la pièce à l'aide de son support.
Voici l'équation de la réaction chimique entre la soude et l'aluminium qui forme de l'aluminate de sodium et un dégagement de dihydrogène :
Sur certains alliages d'aluminium, la surface devient grise ou même noire lors de cette étape. Cela n'a aucune importance, cette noirceur disparaitra dès les premières secondes de l'anodisation.
Le même bain peut servir à décaper plusieurs pièces mais en général nous le renouvelons à chaque fois. C'est pour cela que nous utilisons seulement le volume minimal pour recouvrir la pièce.
Anodisation :
Dans un premier temps, nous court-circuitons les fils de l'alimentation de courant afin d'ajuster ce courant à la valeur calculée (voir exemple plus haut).
Ensuite, nous connectons l'alimentation au montage. Rappelons que fil de la borne moins doit être relié à la cathode de plomb et celui de la borne plus à la pièce traitée.
Pendant toute la durée de l'anodisation, nous ne devons plus modifier l'intensité du courant électrique.
Durant cette étape, il est souhaitable de surveiller l'évolution de la température de l'acide afin de veiller à ce qu'elle ne dépasse pas 24°C. Si la température s'approche trop de cette limite, il faut la faire baisser ou bien retirer la pièce en terminant l'électrolyse.
Si nous devons faire baisser la température de l'électrolyte pendant cette étape, c'est que nous avons mal préparé notre coup. Pour nous rattraper, nous choisissons parmi différentes méthodes selon les possibilités du moment :
Aluminium
Antimoine
Béryllium
Bore
Cadmium
Cérium
Chrome
Cobalt
Cuivre
Etain
Fer
Magnésium
Manganèse
Nickel
Plomb
Silicium
Titane
Tungstène
Vanadium
Zinc
Zirconium
Pour les alliages, la lettre correspondant au métal de base est indiquée en premier. Elle est suivie par un tiret puis par la liste des symboles et leur teneur en %. Si la proportion n'est pas indiquée c'est parce qu'elle est inférieure à 1%.
A la fin de la désignation on peut avoir un A qui indique qu'il s'agit d'un alliage spécifique à un pays et qui diffère légèrement de ce que prescrit la norme.
La teneur en aluminium est supérieure à 99%. Le deuxième chiffre caractérise l'élément qui constitue la principale source d'impureté, il est égal à 0 si les impuretés ne sont pas définies. Les deux derniers chiffres indiquent le niveau de pureté de l'aluminium.
Exemples :
A-1050 = Teneur minimale en aluminium de 99,50%
A-1070 = Teneur minimale en aluminium de 99,70%
A-1080A = Teneur minimale en aluminium de 99,80%
Exemples :
A-2017 = 4 % de cuivre + Mn + Mg + Si. C'est l'A-U4G de l'AFNOR.
A-2024 = 4 % de cuivre + Mg + Mn.
Exemples :
A-3003 = 1 % de manganèse + traces de cuivre.
A-2024 = 4 % de cuivre + Mg + Mn.
Exemples :
A-4006 = 1 % de silicium + Fe.
A-4043 = 5 % de silicium.
Exemples :
A-5056 : il correspond à A-G5.
A-5754 : il correspond à A-G3.
L'électrolyse de l'eau

2 H2O
 2 H2 + O2
2 H2 + O2 L'anodisation de l'aluminium
2 H2O + H2SO4
 2 H3O+ + SO42 -
2 H3O+ + SO42 - 
La formation de l'alumine pendant l'anodisation
3 O2 + 4 Al
 2 Al2O3
2 Al2O3
L'alumine se forme naturellement sur l'aluminium au contact de l'air mais ce revêtement spontané est très fin et il est donc fragile.
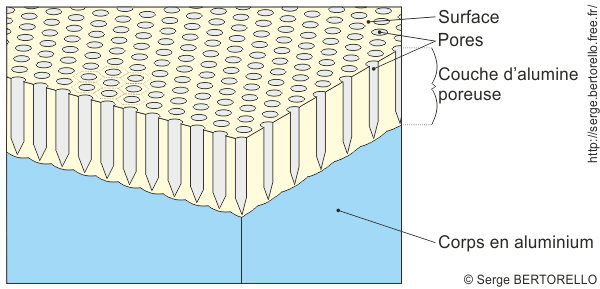
La silhouette hexagonale de certaines cellules a été tracée autour de quelques pores vers la gauche de l'image.
La formule suivante nous donne la vitesse de formation de la couche d'alumine en µm/mn (micromètre par minute) :
V = 0,029.I/S (µm/mn)
La concentration en acide influence la conductivité électrique et ceci n'est aucunement critique. Par conséquent, la concentration de l'acide n'est pas un critère important.
La température optimale pour l'anodisation est 20°C (Il existe bien des procédures qui emploient des basses températures de 1 à 3°C, c'est l'anodisation dure mais il n'est pas question de cette technique particulière dans cet exposé).
Le courant électrique doit être constant lors de l'anodisation car sa variation entraînerait une variation de la distance des pores ce qui provoquerait l'obturation de certains d'entre eux et donc une irrégularité du traitement.




L'anodisation en pratique

L'anodisation entraîne l'émission d'hydrogène qui est susceptible d'une réaction explosive avec l'oxygène en présence d'une flamme ou d'une étincelle. De plus, les bulles de gaz qui éclosent à la surface de l'acide sulfurique diffusent dans l'atmosphère des gouttelettes microscopiques de cet acide qui vont se déposer sur l'environnement immédiat. Cet aérosol va donc corroder les pièces métalliques placées à proximité (le fer va rouiller) et irriter les voies respiratoires de la personne qui aurait la mauvaise idée de les respirer.

La cuve dans laquelle se déroule l'anodisation doit résister à l'acide sulfurique. Le plus souvent, nous utilisons pour cela un récipient en matière plastique conçu pour les produits photographiques que nous employions pour développer nos photos à l'époque de la photographie argentique. Elle a une contenance de 2 litres qui est suffisante pour les petites pièces qui ont moins de 200cm2 de surface.
Nous employons une alimentation de laboratoire 2 x 30V / 3A qui propose au choix une régulation en tension ou en courant avec possibilité de mettre en parallèle ou en série les deux modules.
Comme nous l'avons évoqué, la pièce à anodiser fait office d'anode (elle est reliée au pôle positif de l'alimentation).
Il faut que l'acide puisse circuler sans contrainte tout autour de la pièce à anodiser, on ne peut donc pas la déposer simplement sur le fond de la cuve. De plus, elle doit être mise en contact électrique avec la borne positive de la source de courant.

Déroulement d'une anodisation
Pour qu'elle mérite d'être anodisée, une pièce doit avoir un bon état de surface. Au besoin, un ponçage avec une toile émeri à grain fin (grain 400 par exemple) pourra faire disparaitre des traces d'usinage ou des rugosités diverses.
Le nombre qui est habituellement employé pour qualifier la grosseur des grains abrasifs correspond à la quantité de grains nécessaires pour couvrir une surface de 1 mm2.
C'est le moment d'enfiler un vêtement de protection, des lunettes de protection et des gants en plastique.
Avant de commencer notre séance, nous devons mesurer la température de l'acide sulfurique (nous utilisons l'acide pour batterie de voiture). Pour cela, il nous faut un thermomètre en verre ou constitué d'un autre corps qui ne craint pas l'acide. On peut se le procurer auprès des fournisseurs de laboratoires ou bien chez un fournisseur d'accessoires de cuisine.
Revenons maintenant vers notre pièce à anodiser, on doit la fixer au support qui va servir dans un premier temps pour la suspendre dans un bain de décapage composé d'une solution de soude caustique (Hydroxyde de sodium = NaOH).
2 Al + 2(Na+, OH-) + 6 H2O
 2 [Na+, Al(OH)4-] + 3 H2
2 [Na+, Al(OH)4-] + 3 H2
Sortie du précédent rinçage et sans aucun essuyage, il faut maintenant disposer la pièce dans l'électrolyte selon la disposition de la figure 6 mais tout d'abord sans connecter l'alimentation.

Figure 7 : Accumulateurs de froid.
|
- - Ajout d'acide refroidi en agitant bien le bain.
- Introduction d'un accumulateur de froid dans l'acide en faisant attention à ne pas le laisser trop longtemps et il faudra bien le rincer ensuite. La cuve doit être assez grande... ou l'accumulateur assez petit.
- Disposition autour de la cuve d'accumulateurs de froid tout juste sortis du congélateur.
Habituellement, nous limitons la durée de l'anodisation à 30 minutes.
Quand le temps prévu est écoulé, nous devons sortir la pièce de l'acide et la rincer immédiatement à l'eau du robinet. N'oublions pas que l'acide sulfurique dissous spontanément l'alumine, ces deux corps ne doivent donc pas rester en contact inutilement.
Afin d'éviter de contaminer le (ou les) bain(s) suivant(s), il faut terminer ce rinçage à l'eau déminéralisée.



Figure 9 : Nous utilisons ce colorant destiné aux textiles. Il donne d'excellents résultats sur l'aluminium anodisé.
|
Nous avons choisi un colorant de la marque IDEAL, bien que destiné aux textiles il nous a toujours donné de très bons résultats sur l'aluminium. La photographie ci-contre représente une boîte de ce produit.
Un grand choix de couleurs est proposé mais nous employons seulement le noir.
Le prix est beaucoup plus sympathique. Une boîte de cette teinture coûte seulement quelques euros. Elle est fournie avec un sachet de fixateur qui ne nous est d'aucune utilité. Nous employons seulement le colorant contenu sous forme liquide dans un sachet que nous vidons dans un peu moins d'un litre d'eau déminéralisée (pour faire un litre de mélange).
La pièce fraichement anodisée est séparée de son support. Elle doit séjourner 15 à 20 minutes dans cette solution portée à la température de 60° ± 5°C (c'est à dire entre 55 et 65°C). On trouve des thermomètres compatibles avec des températures supérieures à 60°C auprès d'un fournisseur d'accessoires de cuisine.
Selon notre routine habituelle, nous faisons chauffer le bain de colorant dans une casserole émaillée pendant que se déroule l'anodisation proprement dite. Ainsi il est prêt pour recevoir la pièce dès qu'elle est rincée à sa sortie de l'acide. A ce moment, nous la posons simplement sur le fond de la casserole sans son support.
Nous avons défini cette procédure en nous inspirant du mode d'emploi d'un colorant industriel : Noir Corsé Sanodal MLW.
Ces conditions sont nécessaires pour que le colorant pénètre correctement dans les pores de l'alumine.
Le bain ainsi préparé peut servir à nouveau de très nombreuses fois...
 Figure 10 : Voici la pièce en aluminium de la figure 8 après coloration (en noir). |
Après cette coloration, on sort la pièce du colorant pour l'immerger directement dans le bain de colmatage ou après un rapide rinçage à l'eau déminéralisée.
Un correspondant m'a signalé la possibilité d'employer l'encre pour imprimante à jet d'encre pour la coloration des anodisations en récupérant des cartouches usagées.
Pour cela, on prend des cartouches d'encre noire ou couleur usagées (et a priori vides...), on les ouvre pour récupérer la mousse imbibée d'encre qu'il faut ensuite faire dégorger dans de l'eau déminéralisée chauffée à l'ébullition.
On obtient ainsi des colorants noir et selon les trois couleurs primaires. En les mélangeant dans les bonnes proportions, il est possible d'obtenir ainsi toutes sortes de couleurs.
Colmatage :
Cette eau ne doit pas être polluée par des ions indésirables et par conséquent elle doit être déminéralisée.
Pour cela, nous achetons au rayon droguerie d'un supermarché l'eau déminéralisée destinée au repassage. Il nous arrive aussi d'employer l'eau de pluie ou l'eau de condensation d'un climatiseur.
Parfois, nous immergeons la pièce alors que l'eau est encore froide mais nous ne décomptons le temps qu'à partir du moment où elle commence à bouillir.
Pour une meilleure efficacité de chauffage, nous mettons un couvercle sur la casserole pendant cette opération.
Quand le temps prévu pour cette étape est écoulé, nous plaçons la casserole sous le jet d'un robinet pour refroidir l'ensemble. Puis nous prenons la pièce en main et nous l'essuyons.
Il ne reste plus qu'à contempler le résultat.
Voici des sites de fournisseurs que l'on m'a signalés mais que je n'ai pas testés.
Reston : Kit d'anodisation de l'aluminium.
Electronic-thingks : Produits divers pour anodisation, site écrit en anglais et en allemand.
Les traitements des surfaces d'aluminium de magnésium et du titane / M.WRZECIAN / Editions BPI : C'est un ouvrage de référence en langue française. Cet ouvrage décrit surtout la pratique et il est très facile à lire. Je vous le recommande fortement.
ALUMINIUM, LE MATÉRIAU DE L’AVENIR / Cahier IBS
L'anodisation / J. Laakmann : Article paru dans la revue Elektor du mois de septembre 1984.
ALLIAGES D'ALUMINIUM / Euralliage : Dossier d'information sur les alliages d'aluminium.
Serge BERTORELLO
Cette opération consiste à immerger la pièce traitée dans l'eau bouillante pendant un temps égal (au moins) à la durée de l'anodisation.
Fournisseurs
Documentation

